ゲノム解析とAIで食道がんの術前化学療法の効果予測に成功 理研、近畿大、東京大の共同研究グループ

食道がんの全ゲノムおよびRNA発現データを解析し、AI(人工知能)で食道がんの術前化学療法の効果を予測することに成功したと日本の研究グループが発表した。事前にがん化学療法の効果を予測するがん精密医療や、新しいがん免疫療法の開発に貢献するものと期待される。
ゲノム解析で化学療法に対する好中球群の抵抗性を発見
研究成果を発表したのは、理化学研究所(理研)生命医科学研究センターがんゲノム研究チームの笹川翔太研究員、中川英刀チームリーダー、近畿大学医学部外科学教室上部消化管部門の安田卓司主任教授、東京大学医学部附属病院22世紀医療センター免疫細胞治療学講座の垣見和宏特任教授らの共同研究グループ。日本における食道扁平上皮がんの標準治療は、複数の薬剤を組み合わせた化学療法の後に切除手術を行う「術前化学療法+手術」だが、食道がんは極めて進行が早く、全身の広範囲に転移を伴うことが多い悪性度の高い腫瘍であり、術前から潜んでいるとされる全身の微小転移をどれだけ制御できたかが予後を大きく左右する。しかし化学療法の効果は40~60%で効果予測も困難なため、もし化学療法の効果が見られず腫瘍が増大した場合、切除手術の機会を失うこともあり得る。つまり食道扁平上皮がんにおいては、化学療法の効果を事前に予測することが患者の予後のために非常に重要になっている。この重要性は以前から共有されており様々な先行研究が行われているが、いまだ実用にまでたどりついていない。
一方、食道扁平上皮がんの全ゲノムの構造は既に解明されており、他の部位のがんでは、ゲノム変異情報や腫瘍内での免疫細胞の働きに関する情報を組み合わせ、術前治療の効果予測が行われている例があることから、研究チームでは食道扁平上皮がんのゲノム変異情報や、遺伝子発現から推測した免疫細胞の働きから、化学療法の効果を予測するアルゴリズムの開発を試みた。
まず、共同研究グループは、近畿大学病院において化学療法開始前に採取した121例の食道扁平上皮がん細胞の全ゲノムシークエンス解析を行い、がん細胞の遺伝子変異に関する網羅的な情報を取得。さらに、このデータと実際の化学療法の効果との関連を調べた。食道扁平上皮がんで最も多い変異はTP53遺伝子(がん抑制遺伝子)の変異だが、その有無と化学療法の効果には関連が見られなかった。がん細胞で起こる遺伝子変異のパターンである変異シグニチャー※1を調べたところ、喫煙によって起こる変異パターン(SBS29)との関連が見られ、喫煙量が多いと化学療法の効果が下がっていたことが確認された。がんのコピー数異常では、食道がんに多く観察されるがん関連遺伝子(CCND1、TP63/SOX2、FGFR1、CDKN2A)が位置する比較的小さな領域のコピー数異常と化学療法の効果には関連が見られなかったが、9番染色体短腕や12番染色体長腕などの大きな領域のコピー数異常には、化学療法の効果との関連が見られた。これらの領域には、NF-κBシグナルなどの炎症関連遺伝子が位置していることから、免疫との関連が考えられた。さらに、がん細胞で起きるコピー数異常のパターン(コピー数シグニチャー※2)を解析したところ、コピー数シグニチャーと化学療法の効果に有意な関連が確認できた。
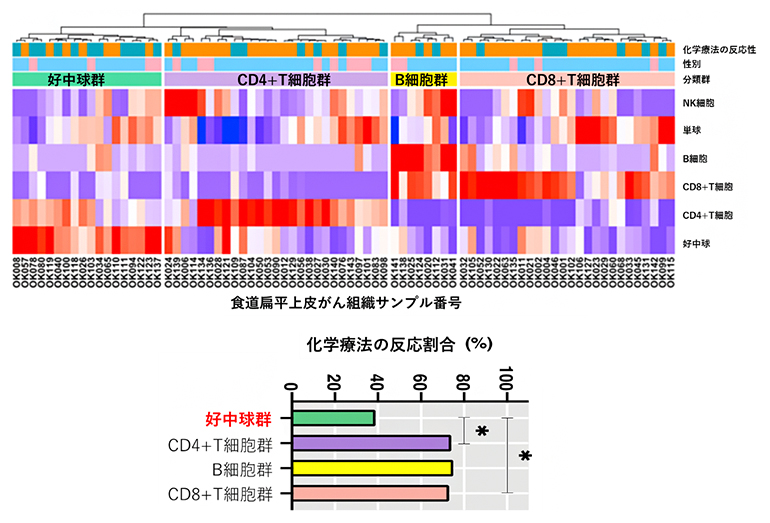
また、がん細胞に対する免疫細胞の働きも遺伝子発現の程度から推測。化学療法の効果との関連を調べるため、121例の食道がん組織のRNA発現解析データを得て、がん組織内に浸潤した免疫細胞の活動性についても解析を行った。このデータに対し、遺伝子発現の傾向を調べるためGSEA※3という解析を行ったところ、IFN-γなどのさまざまな炎症関連の遺伝子群の活性、つまりパスウェイ(遺伝子間の連続的な機能的連関)活性が、化学療法の効果が高い群で上昇していた。さらに詳細に免疫細胞の発現を見ると、食道がん組織に浸潤している免疫細胞に着目し、好中球、B細胞、CD8+T細胞、CD4+T細胞※4がそれぞれ多く発現する四つの群に分類できた(図1上)。注目すべきことに、好中球の多い群では他の群に比べて化学療法の効果が低く、好中球が化学療法の効果と機能的に関連していると考えられた(図1下)。
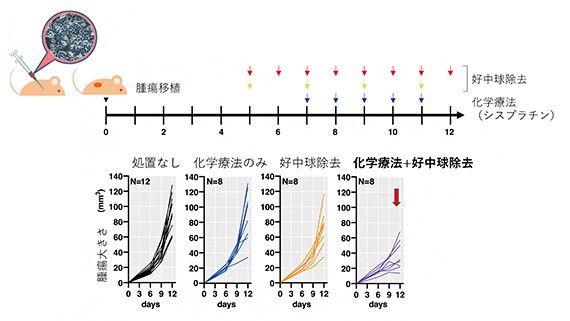
この解析結果を受け、研究グループでは続いて免疫機構が保たれたマウス扁平上皮がんモデルを作製。好中球を除去すると化学療法の効果が大きく向上し、腫瘍の増殖が抑制されることを証明した(図2)。
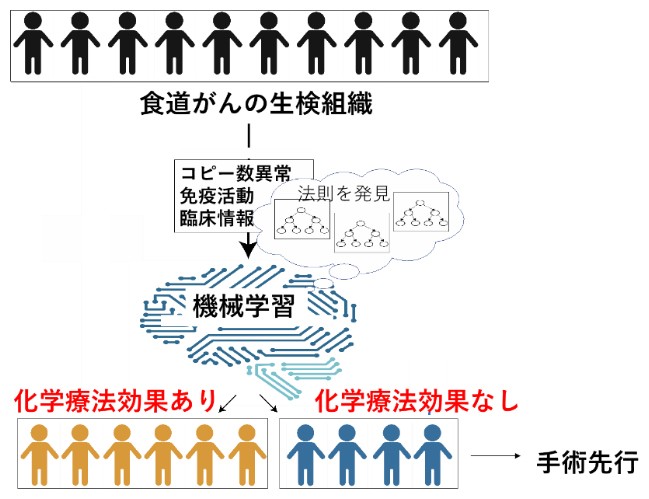
食道がん組織の全ゲノムシークエンスとRNAシークエンスにより、コピー数異常と腫瘍免疫の活動性を解析する。臨床情報も含めた機械学習により、化学療法の効果を事前に予測して層別化し、効果が期待できない患者については手術療法を先行する。
さらに研究グループでは、121例のゲノム変異情報と腫瘍免疫情報に、喫煙量、年齢、性別などの臨床情報を加えた81項目の個々の症例の情報を統合し、機械学習によって化学療法の効果を予測するアルゴリズムを開発した(図3)。この手法により、化学療法の効果に最も寄与する因子は、腫瘍内への好中球の浸潤と腫瘍細胞のコピー数シグニチャーであることが判明した。また、開発したアルゴリズムの診断精度を調べるため、121例のほかに新たな20の食道扁平上皮がん症例についても同様に解析。その結果、診断法の有用性を示すAUC=0.8(1に近いほど精度が高い)の値が得られ、診断精度の再現性が確認できたとする。
研究グループでは、本研究で食道扁平上皮がん組織のゲノム情報、免疫情報、性別・生活習慣などのさまざまな情報を組み合わせることで、食道がんの化学療法の効果予測が可能であることが証明されたとしており、食道がん以外の他の腫瘍に対する化学療法の効果予測や精密医療にも応用できる可能性があるとしている。
※1 変異シグニチャー
がん細胞に発生するさまざまな変異は、その要因によって異なるパターンを示す。そのパターンを変異シグニチャーと呼ぶ。がん細胞の変異の一種である塩基置換は、DNAを構成する核酸塩基(A、T、C、G)の化学反応によって起こる。塩基置換のパターンや数は、DNAと反応する遺伝子毒性を持つ発がん物質の暴露と、変異を修復するための細胞内機構の適切な働きの有無によって決定される。喫煙による肺がんや紫外線による悪性黒色腫における塩基置換は、他のがんに比べて10倍以上多く、CがTに置き換わる(その相補としてGがAに置き換わる)パターンが非常に多くなる。
※2 コピー数シグニチャー
コピー数異常のある領域の大きさや、コピー数異常の構造の特徴などの情報を組み合わせ、そのパターンを特徴化したもの。DNAへのダメージやその修復機構の有無、細胞周期異常と関連する10~20個のコピー数シグニチャーが報告されている。
※3 GSEA
GSEAは、2群間で遺伝子発現が異なる遺伝子が特定の遺伝子セット(IFN-γに関わる遺伝子セットなど)に偏っているかどうかを調べる解析法。GSEAはGene Set Enrichment Analysisの略。
※4 好中球、B細胞、CD8+T細胞、CD4+T細胞
免疫に関わる白血球は、B細胞、T細胞、マクロファージ、好中球、好酸球、好塩基球などに分類される。B細胞は、異物に対する抗体を産出する。T細胞のうち、CD8+T細胞は腫瘍や感染細胞に直接的に作用する(細胞障害性T細胞)。CD4+T細胞はマクロファージなどから抗原提示を受けると増殖、活性化して、炎症を促すサイトカインを産出し、他の免疫細胞を活性化させる(ヘルパーT細胞)。好中球は強い貪食(どんしょく)能力を持ち、病原体を貪食する。さらには顆粒やサイトカインの放出によって感染部位へ他の免疫細胞を動員し、免疫応答を促進する。





