非侵襲で血液脳関門を「物理的に突破」する新技術開発 京都大

血液と脳の組織液の物質交換をコントロールする「血液脳関門」は、血液からの病原体や有害物質の侵入から脳組織を守る、いわゆるゲートキーパーとして知られている。他方、脳腫瘍やアルツハイマー病といった疾患への薬物療法の効果を薄める「壁」としても機能しており、長年、その機能を毀損することなく治療効果を向上させる手法が求められている。このほど京都大学とスペインの研究機関らの研究グループが、特定の周波数の超音波照射とウイルスベクター技術を融合し、非侵襲的に特定の脳領域に選択的な遺伝子導入を可能にする画期的な手法を開発した。
超音波の照射で血液脳関門を突破する新たな手法
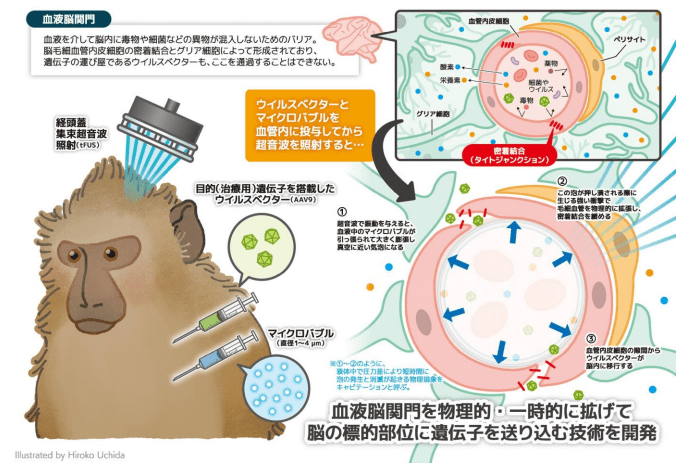
研究成果を発表したのは、京都大学ヒト行動進化研究センター 高田昌彦特任教授と井上謙一同助教、スペイン・神経科学統合センター(HM CINAC)の JoseObeso 教授らの研究グループ。近年、遺伝子治療研究分野では、神経疾患の治療のためにウイルスベクター※1の血管内投与による全脳的な遺伝子導入手法に期待が集まっており、ベクターの脳への移行を妨げる血液脳関門を越えるような遺伝子導入ベクターの開発が精力的に進められてきた。特に最近、9 型のアデノ随伴ウイルスベクター(AAV9 ベクター)やその改変型が 血液脳関門を越えて脳に目的遺伝子を導入できることが示され、マウスでは血管内投与で全脳的な神経細胞への遺伝子導入が可能であることが報告されている。しかしこれらのベクターはサルをはじめ霊長類の脳ではうまく機能していない。今回、研究グループでは、ヒトに近縁なモデル動物であるサル類(マカクザル)において、新規に開発したウイルスベクターと経頭蓋集束超音波照射(tFUS)を利用したベクターデリバリー手法が、非侵襲的に霊長類脳への遺伝子導入が可能か、実用レベルで検証した。
開発した技術は、血管内投与によりサル脳への外来遺伝子導入に成功したキャプシド※2改変型 AAV9 ベクターと、tFUS とマイクロバブル(微小な泡)を組み合わせて血液脳関門を一過性に開放するもので、特定の脳領域に選択的かつ非侵襲的にニューロンへの遺伝子導入を実現可能だとする。この技術開発については、tFUS を利用したヒトパーキンソン病治療の第一人者である、スペイン・神経科学統合センター(HM CINAC)の Jose Obeso 教授の研究グループと連携した。具体的には、tFUS装置を使用し、前もって静脈を介して血液中に送り込んだ マイクロバブルに超音波を当て、そのバイブレーション・キャビテーション効果により特定の部位の BBB を物理的かつ一時的に広げて、血管内投与した AAVベクターを脳の目標部位に局所的に注入し、目的遺伝子の発現を確認したとする。
典型例による説明
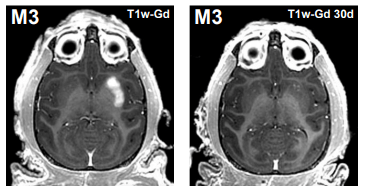
この写真は、造影剤であるガドリニウムを血管内投与して BBB が開放されたサルの脳部位(白いところ)を示す MRI 画像。左は開放直後で、目標部位である被殻※3に限局して比較的広範囲に血液脳関門が開放されている。他方、右は開放後 30 日目で 血液脳関門はすでに閉鎖しているため、ガドリニウムの沈着は認められない。
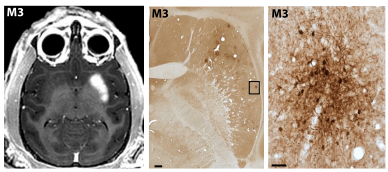
この写真は、MRI 画像(左)で示された BBB の開放部位とほぼ同じレベルの被殻の免疫組織化学染色像で、スライスした脳組織を GFP(AAV9 ベクターに搭載されたレポータ)に対する抗体で染色したもの。右は中央の四角で囲んだ部位の拡大写真で、多数のニューロンにGFP が発現している(目的遺伝子が導入されている)ことが確認できる。
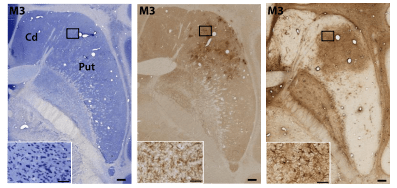
この写真は、上の GFP 染色像とほぼ同じレベルの被殻の組織標本。右は細胞構築を示すニッスル染色像、中央は炎症性ミクログリアの集積を示す Iba1 抗体による免疫組織化学染色像、右はアストログリアの集積を示す GFAP 抗体よる免疫組織化学染色像で、それぞれ左下は四角で囲んだ部位の拡大となる。これらのデータから多少の局所的な炎症は認められるものの、組織損傷は認められないことがわかる。
以上の結果は、tFUS とウイルスベクターの血管内投与により、非侵襲的に特定の脳領域に選択的な遺伝子導入を可能にする手法をサルにおいて確立したことを示しているとする。研究グループでは、特定の脳領域に選択的かつ非侵襲的な遺伝子導入を実現する今回の成果は、遺伝子治療技術を飛躍的に進展させ、特にパーキンソン病などの神経疾患に対する安全な治療法の開発に大きく寄与することが期待されるとしている。
※1 ウイルスベクター:遺伝子情報の運び屋
※2 キャプシド:ウイルスゲノムを取り囲むタンパク質の殻
※3 :被殻 大脳基底核を構成する線条体の一部で、黒質からドーパミン入力を受ける





