既存のがん治療薬にブドウ糖結合、悪性脳腫瘍へ集積させる技術開発に成功 ナノ医療イノベーションセンターら
日本の研究チームが、既存のがん治療薬を悪性脳腫瘍の治療へ効率よく応用できる技術を研究開発したと発表した。薬剤成分にブドウ糖を結合し脳腫瘍が形成する関門を通過させ、腫瘍内へ選択的に集積させることに成功したという。
免疫チェックポイント阻害薬にブドウ糖を結合 標準使用量15%の単回投与で完全奏効率60%
成果を発表したのは、公益財団法人川崎市産業振興財団ナノ医療イノベーションセンター(iCONM)と東京大学大学院工学系研究科バイオエンジニアリング専攻との共同研究チーム「COINS」。がんへの新しい有効な薬剤として期待される免疫チェックポイント阻害剤(ICI)は、様々な部位のがんで良好な成績を残しつつあるが、悪性脳腫瘍(脳転移がんも含む)に対しては臨床試験で満足のいく有効性が示せていない。これは脳腫瘍の血管壁が形成する「血液脳腫瘍関門」により、脳腫瘍への免疫チェックポイント阻害剤の集積が抑えられていることが一つの要因とされている。一方で、脳腫瘍内のICI濃度を治療可能域まで高めようと投与量を上げると、免疫関連有害事象が生じてしまうという問題が存在している。
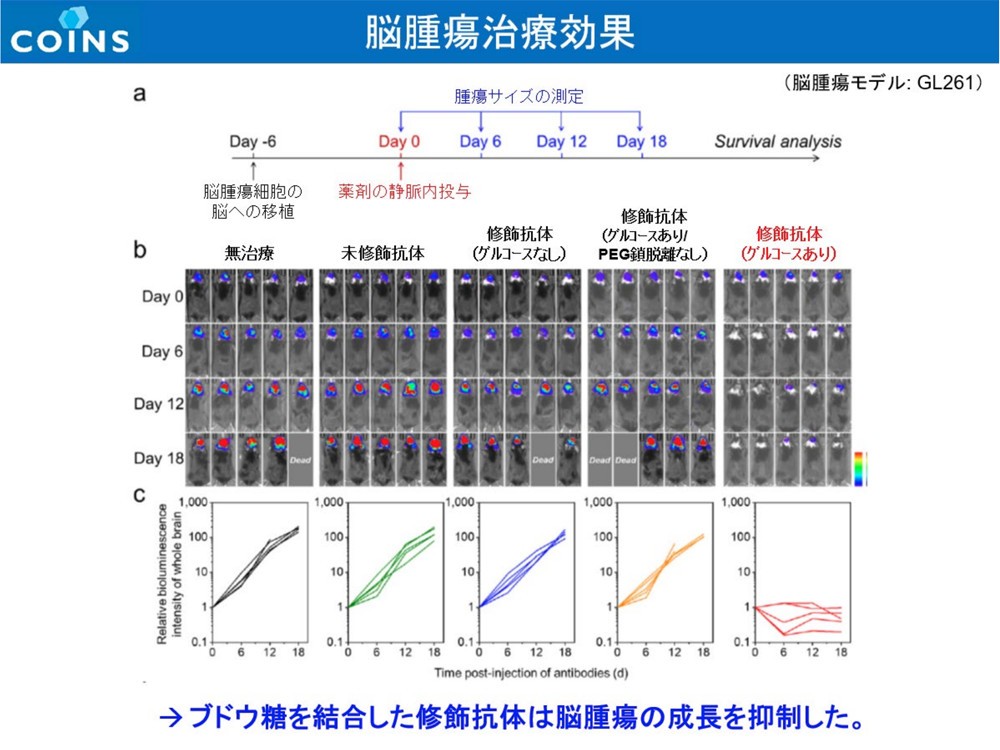
そこで研究チームは、その解決策として、脳腫瘍へのブドウ糖の取り込みが亢進していることに着目。ICIにブドウ糖残基をもつ高分子を複数修飾することで、ICIを脳腫瘍に対して効果的に送達できる可能性を見出し実験した。具体的には、悪性神経膠腫(GBM︓グリオブラストーマ)を移植したモデルマウスに対し、「アベルマブ※1」ブドウ糖残基をもつ高分子を複数修飾した抗体を作成、投与し観察。投与開始4時間後に未修飾のままのアベルマブと比較して18倍もの量送達されていること、脳腫瘍への集積量が正常な脳組織の33倍に達したことを確認した。
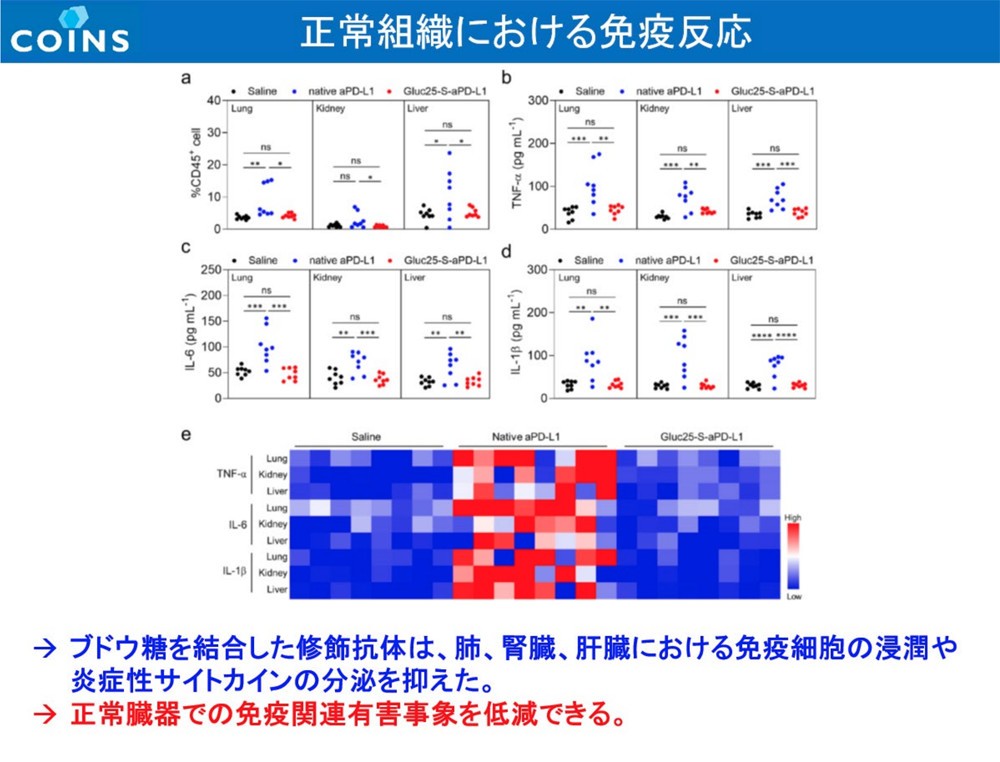
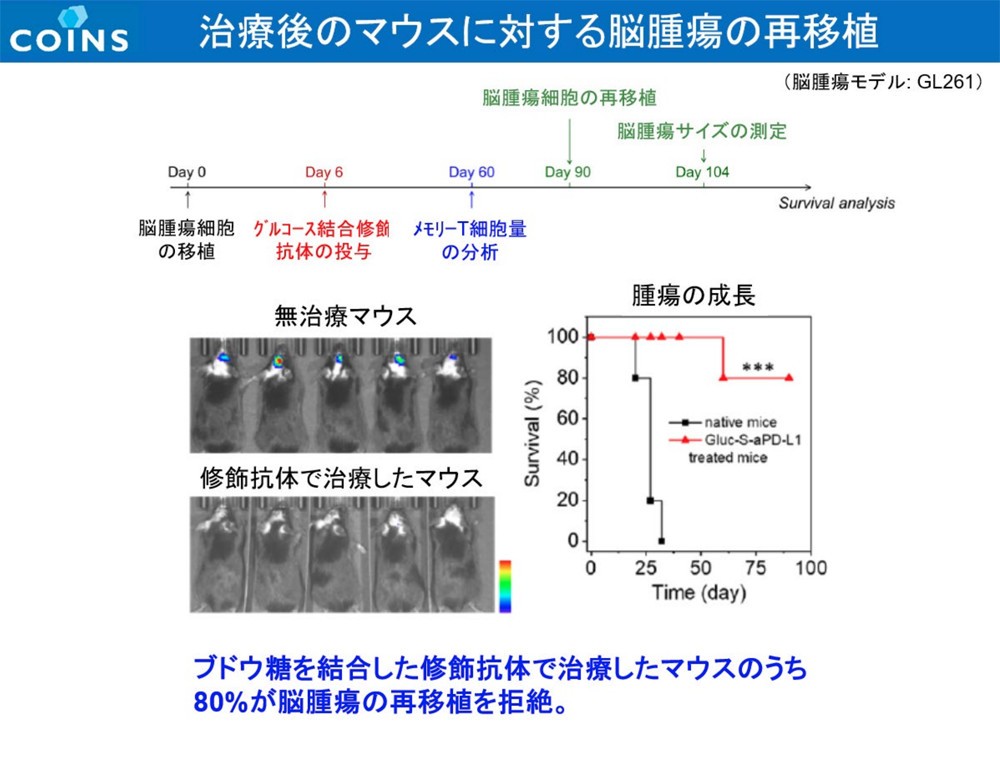
また、研究チームは作成した抗体を、脳腫瘍内特有の環境下(還元的環境下)では高分子が外れ、ICIが脳腫瘍内でのみ活性化するよう設計。脳腫瘍に到達する前に活性化して副作用が発現しないようにしており、その効果も実験で検証した。これについても、実際に腫瘍内で高分子が外れてICIが遊離し、活性化することで発言する高分子化合物(Glc-ICI)を確認。さらに、単回、低容量(標準とされる量の15%=10mg/kgに対し1.5mg/kg)であるにもかかわらず60%の完全奏効率を達成。さらに、奏効し60日以内に完全奏効(腫瘍消失)したマウスの脾臓にエフェクターメモリーT細胞が確認でき、そのマウスにGBM細胞を再移植しても発がんが確認されなかった。研究チームでは、この手法によりGBMに対する免疫が長期間にわたって形成されることが確かめられたとしている。この研究成果は、論文としてNature Biomedical Engineeringに掲載された。
※1 アベルマブ
ヒト型抗PD-L1抗体として開発された免疫チェックポイント阻害剤。「バベンチオ」の製品名 で、根治切除不能なメルケル細胞癌、転移性腎細胞癌、尿路上皮癌への使用で国内承認を得ている。ヒト型 抗体であるものの動物モデルにおいても自然および獲得性の免疫作用で活性化が確認されている。





