メドメイン、デジタル標本で印環細胞癌を検出するAI開発に成功 精度はAUC0.99
デジタル病理診断支援ソリューションを提供するメドメイン(福岡市)は、胃の内視鏡生検病理組織のデジタル標本を解析し、印環細胞癌を検出する人工知能の開発に成功したと発表した。判別能を評価する指標であるROC-AUCが0.99という極めて高い精度の結果が得られたとしている。
共同研究者「がんの有無を越えた次のステージに飛躍させる研究成果」

胃に高頻度でみられる印環細胞癌は、細胞質内に貯留した粘液が細胞核を辺縁に圧排する細胞形態が特徴的であり、癌細胞が印環のように見えることから「印環細胞癌」と呼ばれている。胃印環細胞癌の予後に関して、特に、胃の粘膜下層以下に浸潤した癌では硬性癌(スキルス胃癌)となって発見される例が多く、リンパ節転移や腹膜播種、癌性リンパ管症などを伴い予後不良とされる。今回、メドメインは広島大学病院 病理診断科の有廣 光司教授、札幌厚生病院 病理診断科 市原 真主任部長とを中心とする研究グループと多施設共同研究を行い、生検病理組織のデジタル標本を解析し、印環細胞癌の検出を可能にする人工知能の開発を目指した。
具体的には、広島大学および国際医療福祉大学三田病院より胃内視鏡生検病理組織標本の提供を受け標本をデジタル化したのち、深層学習のための教師データを複数の病理医が作成。深層学習を行うことで人工知能を開発し、広島大学・国際医療福祉大学三田病院およびDigestPath2019から提供をうけたデジタル標本を検証症例として用い、精度の検証を行った。
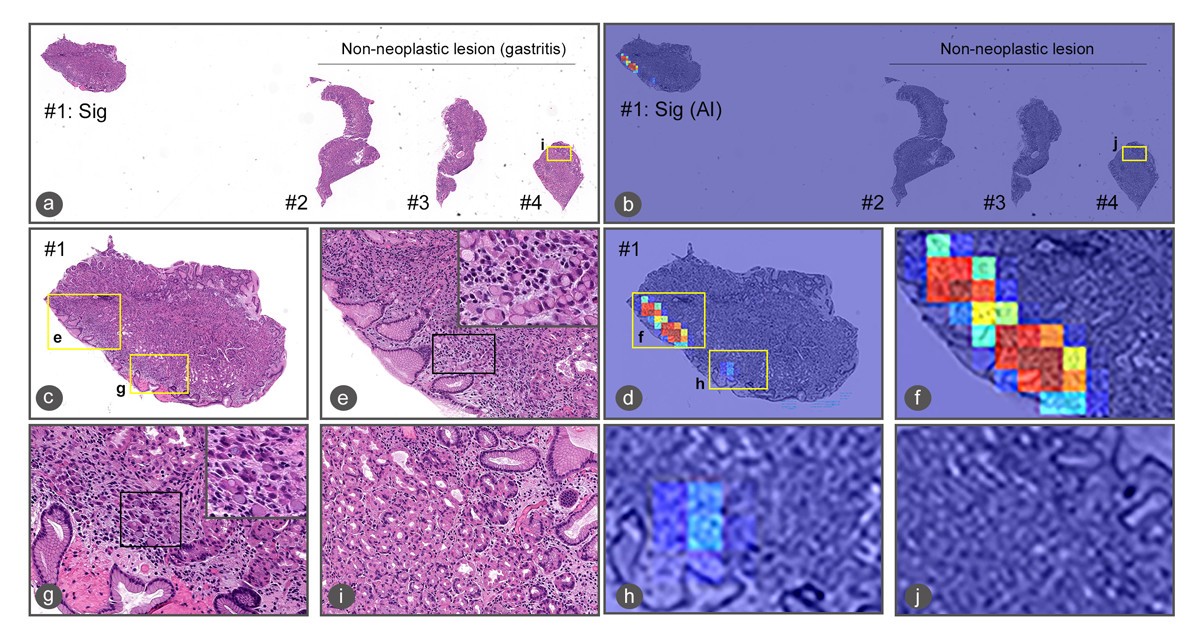
その結果、学習方法や倍率を変え開発した複数の人工知能モデルすべてで、印環細胞癌の検出においてROC-AUCが0.99という極めて高い精度の結果が得られたという。また同時に、人工知能が検出した印環細胞癌を示唆する領域(ヒートマップ)は、病理医による検証で妥当であることも確認された。同社では今後、今回開発した人工知能モデルの精度を複数施設で検証する予定。
研究成果については、共同研究者である札幌厚生病院 病理診断科の市原 真主任部長が報道発表で詳しく解説しており以下に詳報する。
共同研究者コメント(札幌厚生病院 病理診断科 市原 真主任部長)
胃のいわゆる未分化型癌(Nakamura K, et al. 1968)に分類される印環細胞癌の判別が可能となったことは、臨床診療的にも病理診断的にも大きなインパクトを持ちます。なぜなら、本研究によって今後、胃癌の人工知能解析においては「癌細胞がここにある」と認識する単純な存在診断ではなく、「ここにある癌が高分化型管状腺癌なのか、それとも印環細胞癌なのか」と弁別する=組織型分類ごとにマッピングを塗り分けることが可能になると期待されるからです。
現在、早期胃癌(癌が粘膜下層までの浸潤に留まっている癌)の層別化診療においては、印環細胞癌の成分を的確に見分けてマッピングすることが極めて重要です。内視鏡的粘膜下層剥離術(endoscopic submucosal dissection: ESD)によって治療された検体は、全例に病理診断が施行されますが、このとき、癌の組織型に未分化型(印環細胞癌、低分化腺癌、粘液癌)の成分がどれだけ含まれているかによって、その後の治療方針が変わります(胃癌治療ガイドライン第5版.日本胃癌学会編,金原出版,東京,2018)。
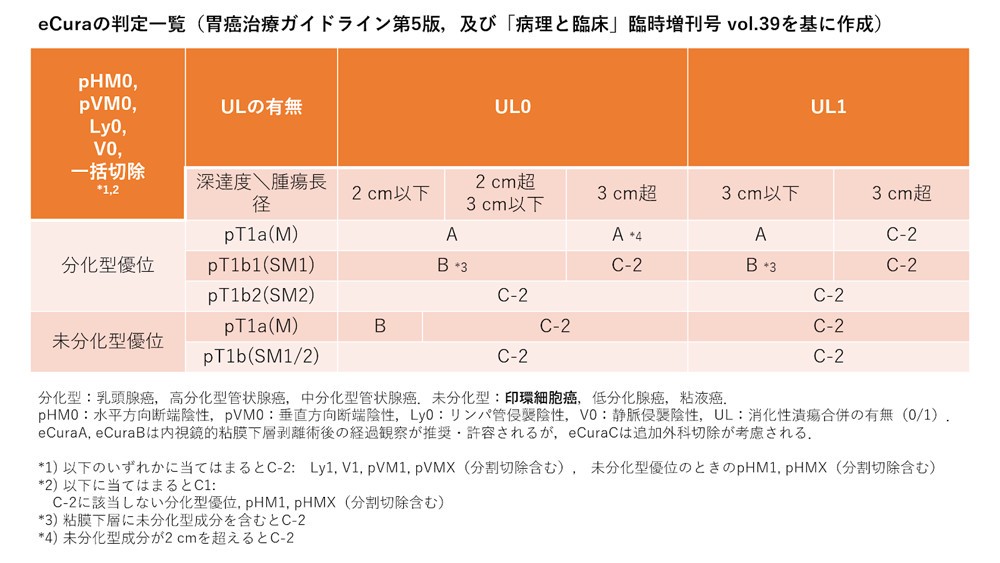
これに基づき、病理診断の現場では、ESD標本において印環細胞癌をはじめとする未分化型成分がどれだけ病変内に含まれているかを、複数枚のプレパラートすべてにおいてマッピングし、未分化型成分の総量と長径を記載しなければいけません。この作業は病理診断の現場に膨大な負担をかけます。

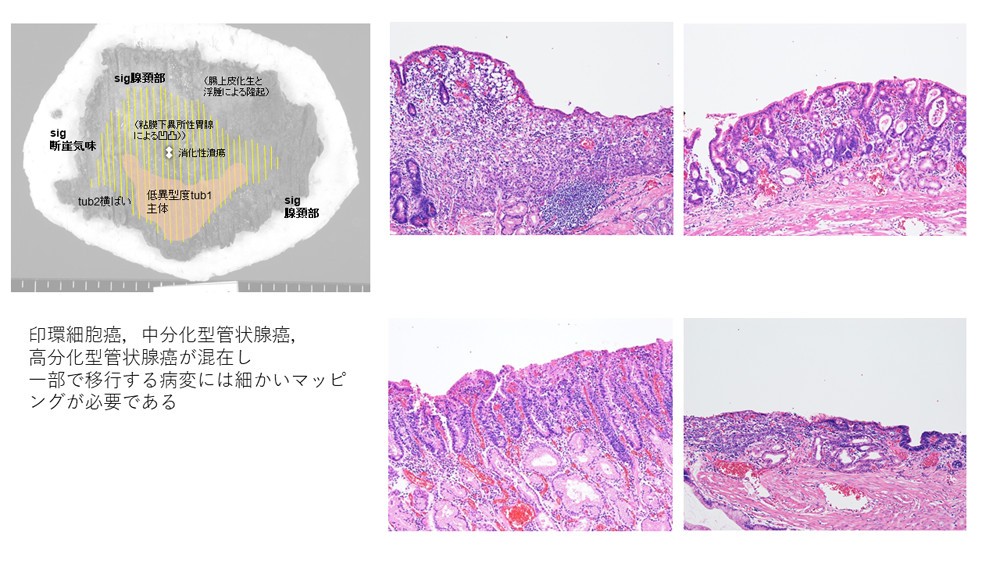
胃癌の二大組織型である分化型と未分化型を、人工知能診断が双方カヴァーして「塗り分ける」ことは、病理診断の労力軽減、精度向上に大きく寄与し、胃癌診療の方針決定シークエンスにおいて強力なツールとなることでしょう。
現在、胃癌に限らず多くのがんで「病変内の多様性」が観察され、その一部は患者予後に影響することがわかってきています(参考:治療方針を変える病理所見 診療ガイドラインと治療戦略.病理と臨床臨時増刊号.2021,vol.39,東京,文光堂)。しかし、組織所見の多彩さのあまり、人力ではもはやマッピング・塗り分けが困難と感じる場面も多く経験されます。今回、分化度の低い癌腫をマクロファージや正常断片化細胞と精度高く弁別しながらヒートマップ表示できたことで、この先あらゆる癌腫において低分化な癌腫成分をはじめとする病変内多様性がマッピング可能になるのではないかと期待されます。人工知能による病理診断支援を、「がんのある・なし」を越えた次のステージに飛躍させるだけのポテンシャルを持った研究成果であると考えます。





