「SaMDファストトラック」3品目を初めて選定

厚生労働省は27日、プログラム医療機器調査会薬事・食品衛生審議会を開催し、プログラム医療機器(SaMD)優先審査制度の適用申請を求めてきた13社14品目の中から3品目を選定することを了承した。同制度初めての適用となる。
選定された3品目の概要
i2medical・慶應義塾大学医学部・住友ファーマの協業プロジェクト「SWIFT」
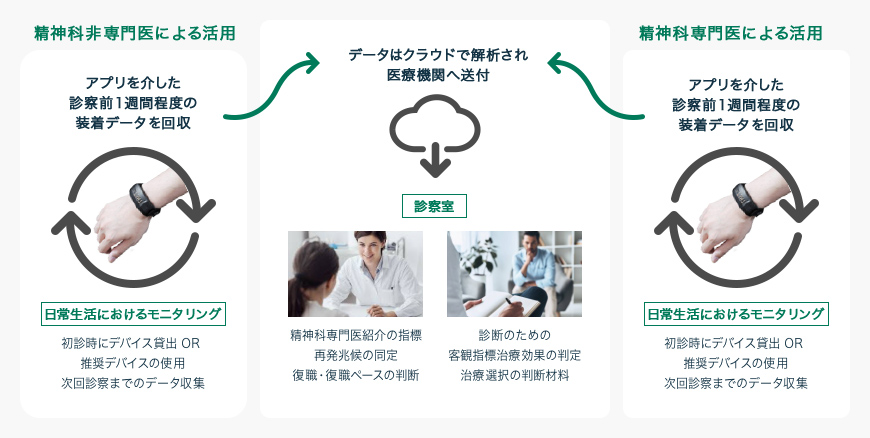
これまで単一の指標では評価が難しかった抑うつ症状を、リストバンド型のデバイスを装着し、搭載されている複数のセンサーで得られる様々な生体・活動データを総合的に評価することで、うつ病の診断における客観的指標の提供を目指すプロジェクト。AMED研究プロジェクト「PROMPT」での研究成果がベースとなっている。
クアドリティクス「心拍変動解析に基づくてんかん発作警告機」
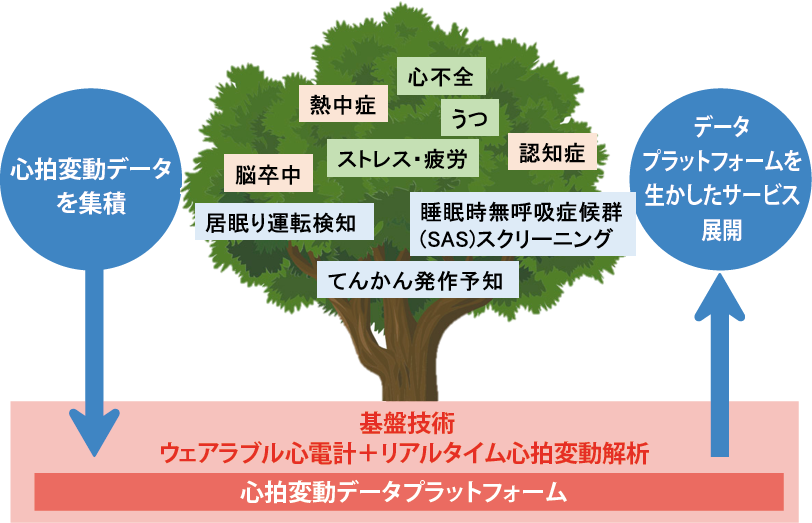
心拍変動データ解析の知見を中心として事業展開するクアドリティクス(京都府)による、てんかん発作前に兆候を検出し、アラームを発報するプログラム医療機器開発プロジェクト。
Xcoo「Chrovis Clinical Annotation がんゲノムレポーティング」
Xcoo(テンクー/東京都)が開発したゲノムおよび生体情報解析のトータルソリューション「Chrovis」をベースとした、がん遺伝子パネル検査で検出された遺伝子バリアントの臨床的意義を自動判定するプログラム医療機器の開発プロジェクト。
指定要件は3つ、日本での先行承認を求める
本年度から試験導入される優先審査制度については、昨年厚生労働省が発出した事務連絡で、優先審査を受けられる指定要件を以下としている。
(1)指定要件1:治療法、診断法又は予防法の画期性
(2)指定要件2:対象疾患に係る医療上の有用性
(3)指定要件3:世界に先駆けて日本で早期開発及び承認申請する意思並びに体制
指定を受けた品目は、承認申請から承認までの時間を短縮するための以下の優遇措置を受ける。
(1)優先相談
(2)事前評価の充実
(3)優先審査対象として指定
(4)PMDA(医薬品医療機器総合機構)においてコンシェルジュの配置
同省は2023年度以降の本格運用に向けて、業界とも意見交換しつつ検討するとしている。





