機能性表示食品に関する論文の8割超、広告は7割超で優良誤認の疑い 国内で初の調査

日本独自の制度である「機能性表示食品」に関する論文と、それに基づいた広報・広告の内容について、国内で初めての調査結果が公表された。多くの中から100件のみをサンプル調査したものに過ぎないが、深刻な課題が提示されている。
論文と広報双方に優良誤認の疑念、多数発見
国内独自の「機能性表示食品制度」は、国の認可を経ずとも申請のみで食品の機能性を表示できる制度。機能性食品市場は年々拡大し、食品の機能性を確認するための臨床試験も多く行われている。その試験の一部は食品の製造・販売会社が直接行うのではなく、開発業務受託機関(CRO)に委託されることもしばしばあります。CRO が実施した臨床試験の質や、臨床試験の結果がどのように消費者に伝えられているかはこれまで詳細に検討されていない。
今回、国内8施設の研究者からなるグループは、UMIN 臨床試験登録システム※1に日本の大手 CRO5社によって登録された臨床試験 726 件のうち100 件をランダムに抽出。その中から食品に関連したものを選び、それらの研究の質を検討した。また、それらの研究結果のプレスリリースあるいは、研究結果をもとにして販売された商品の広告において、研究結果がどのように広報されているかについてもあわせて検討した。国内でこうした分野のメタ疫学研究は初めてとみられる。
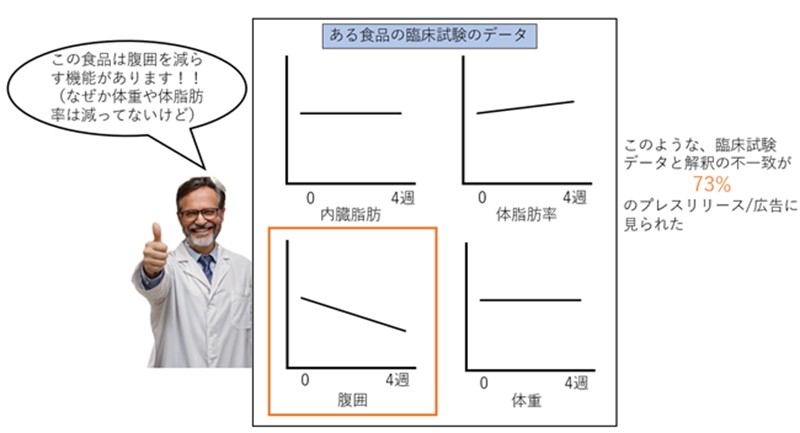
100件のうち76 件が食品に関連し、32 件が論文として出版、臨床試験の結果を広報する3件のプレスリリースと、臨床試験をもとに製造、販売された食品の広告8件、計 11 件を同定した。32 件の論文では、実際に報告された主要評価項目の数が、計画段階の主要評価項目の数のおよそ2倍になっていた(中央値)。さらに、32 件のうち 26 件(81%)の論文の抄録で、結果と結論の不一致(spin)※2 が認められた。11 件のプレスリリースおよび広告のうち、8件(73%)にも結果と解釈に不一致(spin)がみられた。
研究グループでは、本研究はあくまで日本の機能性表示食品の臨床試験の一部だけを評価したものだが、しかし一部の試験だけであっても結果と結論に不一致があり、それがそのまま消費者やメディアに伝えられていることは大きな問題だとしている。国、あるいは消費者庁が、機能性表示食品について規制の見直しを検討することを提言している。
※1 UMIN 臨床試験登録システム
大学病院医療情報ネットワーク(UMIN)により運営されている臨床試験の登録システム。日本の機能性表示食品は、機能性の根拠となる臨床試験を行う場合、事前に研究計画を登録することを求めているが、その登録先として求められているものの1つ。
※2 Spin
臨床試験で得られたデータのうち都合の良いデータだけを強調し、都合の悪いデータや、矛盾するデータは無視して結論を出すこと。たとえば、試験食品を摂取して4週間後に、腹囲が減っていたとしても、体重や内臓脂肪、体脂肪率が減っていなければ、結果の矛盾について理にかなった説明をする必要がある。





