大規模ゲノム解析で日本人大腸がん患者の発症リスクなど解明 理研、東大ら

次世代シーケンサーなどの技術革新で、がんをはじめとした疾患発症の原因をゲノム解析で明らかにしようとする研究が世界中で盛んになっているが、日本人大腸がん患者を含む世界最大規模、3万6000人以上のDNAを解析し日本人遺伝性大腸がんの原因遺伝子・発症リスク・臨床的特徴を明らかにする研究成果が発表された。それによると、日本人に特有の原因遺伝子の存在の可能性も明らかになっている。
日本人に特異的な病的バリアントも解明
研究成果を発表したのは、理化学研究所(理研)生命医科学研究センターがんゲノム研究チームの藤田征志上級研究員(研究当時)、中川英刀チームリーダー、基盤技術開発研究チームの桃沢幸秀チームリーダー、東京大学医科学研究所の村上善則教授、東京大学大学院新領域創成科学研究科松田浩一教授、埼玉県立がんセンターがんゲノム医療センターの赤木究センター長らの共同研究グループ。大腸がん患者の数%は一つの「病的バリアント」※1が発症原因と考えられているが、日本人大腸がん患者の病的バリアントについての大規模なデータは少なく、日本人集団での病的バリアントの影響は明確には明らかになっていない。
今回、共同研究グループは米国国立包括がんネットワーク(NCCN)ガイドラインで検査が推奨されている12個の遺伝子を含む計27個の遺伝性腫瘍関連遺伝子を対象に、独自に開発したゲノム解析手法を用い、バイオバンク・ジャパン※2により収集された大腸がん患者12,503人および対照群23,705人の血液のDNAを解析した。解析対象の遺伝子は、NCCNガイドラインで検査が推奨されている12遺伝子および研究開始当時に25遺伝子遺伝性がんパネル※3で検査対象となっていた25遺伝子から選抜した15遺伝子の計27個の遺伝性腫瘍関連遺伝子とした。解析の結果、4,804個の遺伝的バリアントを同定し、さらに、これらの遺伝子バリアント一つ一つを米国臨床遺伝・ゲノム学会(ACMG)※4および分子病理学会(AMP)※5が作成したガイドラインや、国際的データベースであるClinVar※6の情報に基づいて、病的バリアントか否か評価。その結果、397個の遺伝的バリアントが病的バリアントであると判定され、そのうち199個(50.1%)はClinVarに未登録の新しい病的バリアントであり、日本人に特異的な病的バリアントである可能性があるとしている。
表解説
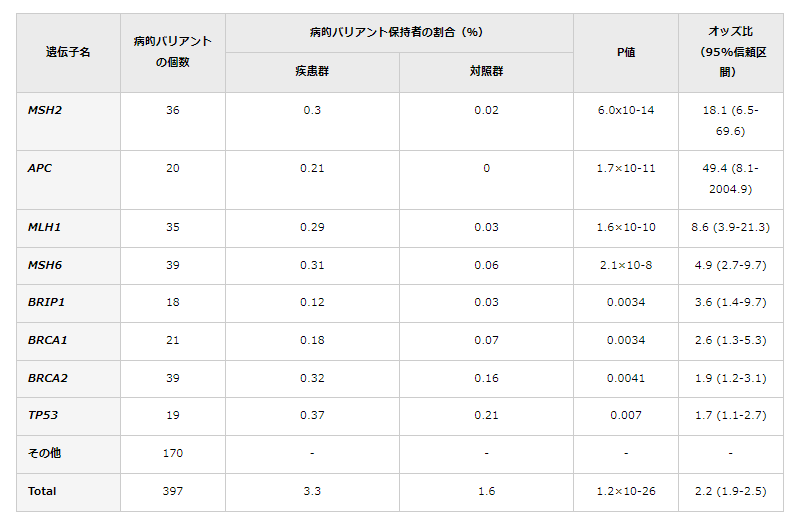
病的バリアント保有者の割合は、患者群で3.3%、対照群で1.6%であり、オッズ比は2.2倍であった。オッズ比は、ある事象の起こりやすさについて二つの群で比較したときの違いを示す統計学的尺度の一つで、病的バリアントを持つことで大腸がんへのなりやすさ(発症リスク)が2.2倍高まることを示す。この表におけるp値は、偶然にそのようなことが起こる確率のことで、統計学的有意差を示す指標である。p値が低いほど偶然では起こり得ないことを示す。
また、同定した397個の病的バリアントを、患者群・対照群それぞれがどのくらいの割合で保有しているか調べたところ、患者群の3.3%、対照群の1.6%が保有しており、病的バリアントを持つことで大腸がんへのなりやすさ(発症リスク)が約2.2倍高まることが分かった(表1)。遺伝子ごとの解析では、8遺伝子(MSH2、MLH1、MSH6、APC、BRIP1、BRCA1、BRCA2、TP53)が日本人集団の大腸がん発症に寄与していることが統計学的に明らかになった(表1)。なかでも、MSH2(p=6.0×10-14)、APC(p=1.7×10-11)、MSH6(p=2.1×10-8)、MLH1(p=1.6×10-10)の4遺伝子が大きく寄与しており(表1)、そのうち3個の遺伝子(MSH2、MSH6、MLH1)はDNAミスマッチ修復遺伝子だった。また、BRCA1(p=0.0034)、BRCA2(p=0.0041)の2遺伝子は、日本人集団における乳がん、前立腺がん、膵臓がんとの関連が既に明らかになっており、ヨーロッパやアジアの研究でも関連が示唆されている。一方で、BRIP1遺伝子(p=0.0034)は、欧米では乳がんや卵巣がんと関連があるものの大腸がんとの関連は報告されておらず、今回初めて関連が示された。
図解説
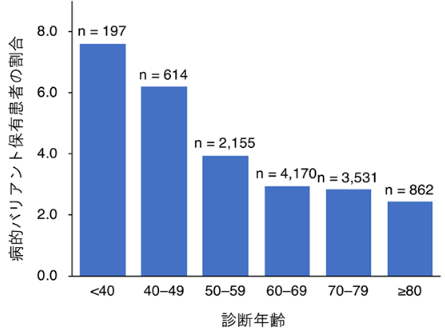
40歳未満で大腸がんと診断された患者の7.6%が病的バリアントを保有しており、最も割合が高かった。病的バリアント保有者の割合は、診断時の年齢が上がるにつれて有意な減少が見られた(P=2.3×10-7)。
次に、大腸への発がんリスクを高めるリンチ症候群※7の主な原因となるDNAミスマッチ修復遺伝子※8上の「コピー数多型(CNV)※9」を特定するため、以前の研究で用いられた4種類の高密度DNAマイクロアレイデータを使用し、CNVを検出するソフトウェアを用いた再解析および定量PCRを行った。その結果、3遺伝子(EPCAM-MSH2、MLH1、APC)上に30個のCNVが検出され、そのうち23個が欠失、7個が重複[10]でした。さらに、30個のうち23個をMLPA法※10で再確認したところ、18個が翻訳領域に影響していることが分かり、「病的CNV」であると評価した。
また、病的バリアント保有者に臨床的な特徴があるかどうかを、大腸がんの病的バリアント保有患者416人と非保有患者12,087人を比較することで調べたところ、病的バリアント保有患者の数には、診断時の年齢が下がるにつれて有意な上昇が見られ(図1)、保有患者の大腸がん診断年齢は、非保有患者に比べて平均3.0歳若いことが分かった。加えて、保有患者では、4種類のがん(大腸がん、乳がん、子宮内膜がん、卵巣がん)の家族歴や3種類のがん(胃がん、子宮内膜がん、卵巣がん)の既往歴を持つ人が、対照群よりも多いことが統計学的に明らかになった。
※1 病的バリアント
ヒトのDNA配列は30億の塩基対からなるが、その配列の個人間の違いを遺伝的バリアントといい、そのうち疾患発症の原因となるものを病的バリアントと呼ぶ
※2 バイオバンク・ジャパン
日本人集団27万人を対象とした、世界最大級の疾患バイオバンク。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へ分譲を行っている。2003年から東京大学医科学研究所内に設置されている
※3 Myriad myRisk Hereditary Cancer panel
※4 American College of Medical Genetics
※5 Association for Molecular Pathology
※6 ClinVar
※7 リンチ症候群
がんの発症リスクを高める遺伝性疾患の一つで、主に大腸への発がんリスクを高めるとされている。ミスマッチ修復遺伝子の変異が原因であることが判明しており、米国国立包括がんネットワーク(NCCN)では、50歳未満の全ての大腸がん患者にはリンチ症候群の遺伝学的検査を受けることを推奨している
※8 Lynch HT, la Chapelle A de. Hereditary colorectal cancer. N Engl J Med 2003;348:919-32
※9 コピー数多型(CNV)
ゲノム配列の個人間の違いの一種で、ゲノム配列の一部の領域が失われる、もしくは増えて挿入されることによって、その部分のゲノム配列の存在数が増減すること。CNVはCopy Number Variationの略
※10 MLPA法
標的のDNAの配列に結合する配列とPCR法で増幅されるプライマー配列が隣り合ったプローブを用いて、標的配列が存在するかを確認するための手法である。また蛍光強度の程度によって、存在する配列の重複や欠失などの標的配列のコピー数を判別できる。MLPAはMultiplex Ligation-dependent Probe Amplificationの略





