心電図計測が可能な Apple Watch Series 4 が日本で入手できるようになるためには
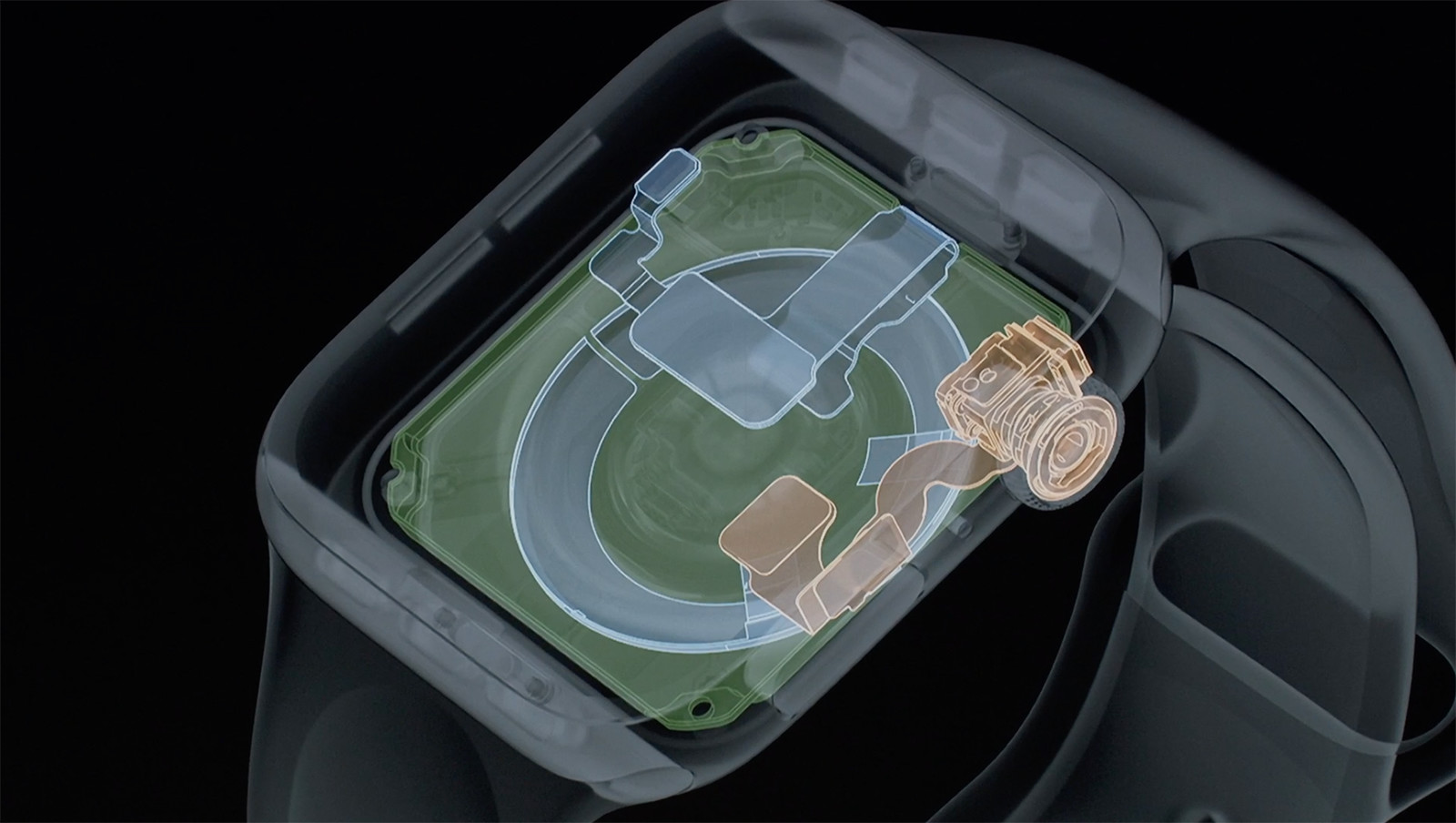
昨日(日本時間)発表されたApple Watch Series 4 の発表は、医療とITに関わる関係者の大きな話題となっている。その中でも昨日から今日にかけ議論になっているのが「日本で心電計として使えるのか否か」。いま得られる情報と今後の見通しなどについて、アイキューブドシステムズ取締役で、東京慈恵会医科大学 先端医療情報技術研究部の畑中洋亮氏にご寄稿いただいた。
——————————————————-
Apple Watch Series4 に心電図計測機能が搭載されFDA認可を受けたという発表がなされ、
米国では使えるけれど日本では使えないようだ、、みたいな記事が乱立を始めた
https://japanese.engadget.com/2018/09/13/apple-watch-series-4-ecg-apple/
ので、簡単に日本でこの機能が利用可能になるための筋道をまとめておきます。
医療機器認証について
「心電図」「血圧計」など、診断や治療方針に影響する機能を有する場合や、機器名を付ける場合は、医療機器の承認を得る必要があります。(心拍数は手でも測れるから該当しません)
https://www.pmda.go.jp/review-services/drug-reviews/about-reviews/devices/0013.html
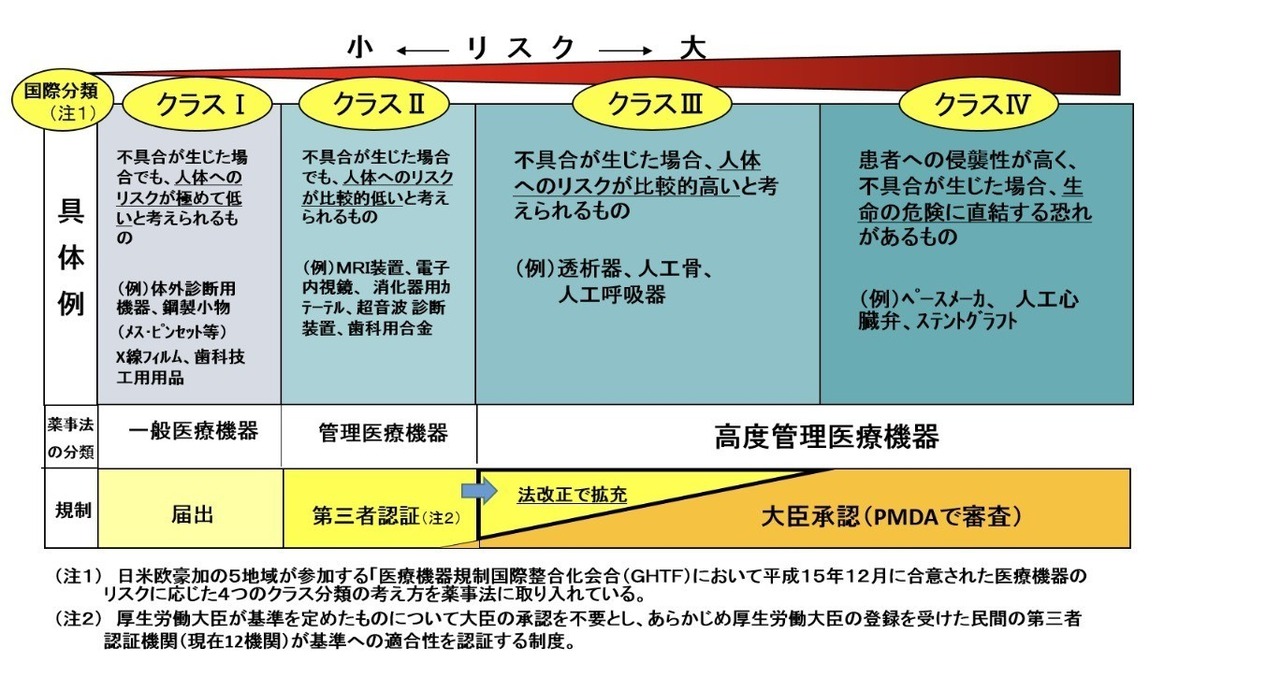
(PMDAホームページより)
「心電図」はクラス2というタイプに分類され、通常は(半ば国の)審査機関とも言えるPMDAではなく第三者認証機関による審査で済みますが、今回はウェラブルデバイスであったり何らかの通知機構という、これまでと異なる領域であることから、PMDAの審査を受けることになるでしょう。
PMDAの審査は、「ゾロ品」と呼ばれるような"後発"・"改良"・"新規"の3パターンで、それぞれ6ヶ月、7-8ヶ月、1年以内の審査機関目標を持っているようです。今回の審査では、通常の心電図を一定時間計測するホルターとの違いや、薬物服用を通知するような通知機構などについて、深く審査されることになるでしょう。
販売について
Apple Watch が医療機器として認証をうけるかどうかと、販売は全く異なる話です。まず、医療機器の販売をするには、医療機器の製造品質・管理品質を担保する必要があるため、医療機器になった Apple Watch の販売代理店網それぞれに、薬剤師や医療機器販売業者等の営業所管理者を配置・採用する必要があります。下記のような講習を受講して取得する有期資格です。
http://www.hapi.or.jp/seminar/hanbai_chintai.html
医師、歯科医師、薬剤師などは免除されますので、多くの家電量販店では、ドラッグストアや調剤薬局も保持するようになったため、資格者はすでに十分配置されていると思います。Appleの中でいるのかどうかは、、わかりません^^
ソフトウェア更新について
当然医療機器としての認証を受けた以上は、大きな変更をする場合は、再度審査を受け直す必要があります。ただ、ソフトウェアを主体とした機器について、当然バグフィクスなどもあるので、一定レベルは泳げるようになっています。
レイアウト変更程度は無断で問題ないし、OSアップデートなども問題はないようです。ただし、大きな機能追加がある場合は審査が必要で数ヶ月は要するようです。
なお、そもそもこれらウェラブルデバイスは医療機器なのか?ヘルスケアデバイスではないのか?審査が必要なのか?といった議論は、ビジネスをやりたい側の官民ここかしこで出て来ているようですが…やはり求められているのは医療機関が参照にし得るほどのデータ精度であろうことや、利用する国民側の不十分な告知による不利益などから、医療機器としての審査プロセスの見直し・審査加速が妥当で、審査不要にするような誤った判断をするべきではないと考えます。
さて、ここまで書いてきたことは、Apple Watchがハードウェアとして医療機器認証を目指す、という場合の話です。実は今回の Apple Watch Series 4 について、FDA認可が下りたと書かれていますが、実際は、Apple Watch そのものではなく「ECG/EKG」「Heart Rate Alert」の2つのアプリに対して認可(Clearance)が出たというのが正確な事実のようです。
https://www.fda.gov/MedicalDevices/DigitalHealth/SoftwareasaMedicalDevice/ucm587925.htm
https://www.mobihealthnews.com/content/scoop-emails-show-fda-asked-apple-advise-software-medical-device
実は、ソフトウエア、特にモバイルアプリケーション単体で医療機器とする software as a medical device(SaMD)という領域は、Apple も交えて国際的な審査/規制基準制定が International Medical Device Regulators Forum (IMDRF)にて進んでいます。
http://www.imdrf.org/about/about.asp
この辺りの国際的な取り組みの背景も含めて、しっかりと日本の行政・アカデミアが議論に参加して、国民に不利益が生じないようにしなければならないと思います。
以上、私も医療機器認証/販売の専門家、と呼ぶほどではないのですが、身近で認証を受けたり販売に関わるメンバーもいますので、おおよそ正しいと思います。
詳細を聞きたい人は、医療機器開発に詳しい本学講座メンバーで取材に応じますので、ご連絡ください。
http://dimitjikei.jp/info/
寄稿:畑中洋亮(はたなか・ようすけ)氏
慶應義塾大学理工学部化学科卒。東京大学医科学研究所で遺伝子医学に従事、生命科学修了。2008年 Apple Japan へ入社、iPhone日本法人市場開拓を担当。ICTによる現場から医療構造改革を目指す「Team医療3.0」を結成、ソフトバンク孫社長との対談が書籍化。2010年 日本最大モバイルセキュリティサービス「CLOMO」を提供するアイキューブドシステムズへ転籍、同社取締役。2016年 東京慈恵医科大学後期博士課程に進学、慈恵医大のiPhone導入支援に加え、高尾洋之准教授らとJoinなど研究・事業開発も進めている。株式会社コトブキ 取締役
東京慈恵会医科大学 先端医療情報技術研究部 後期博士課程
神戸市立神戸アイセンター病院 客員研究員